|
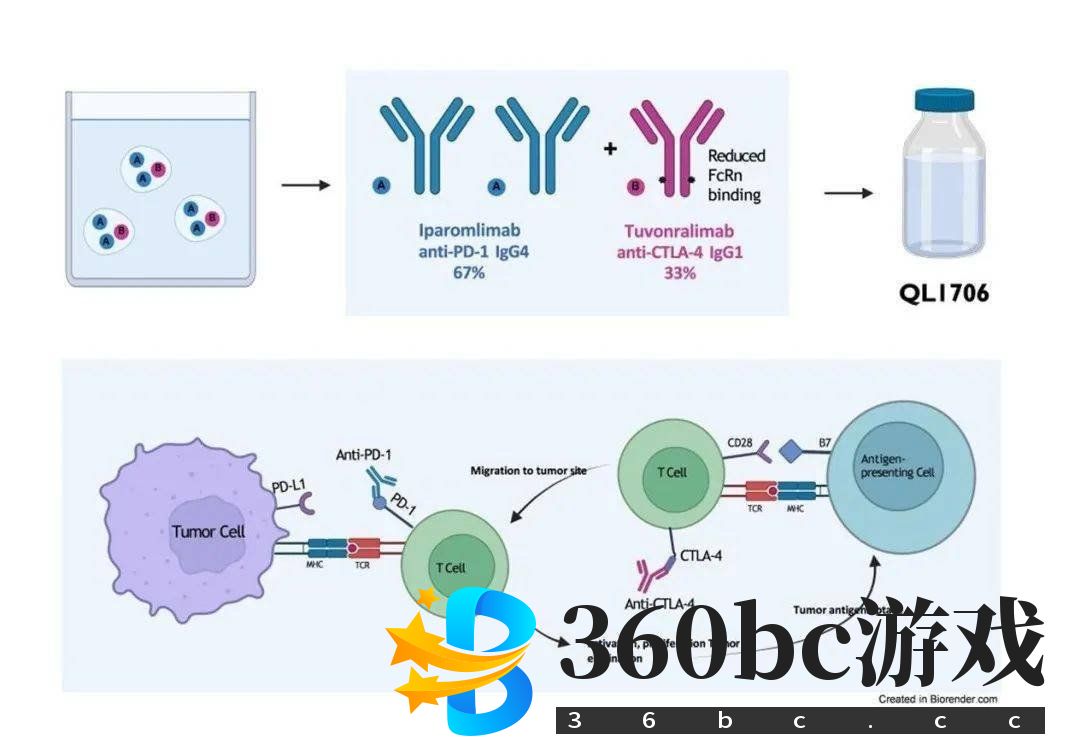
为使更多r/mCC患者从免疫治疗中获益,靶向PD-1/PD-L1轴和细胞毒性T淋巴细胞抗原 4(CTLA-4)的检查点抑制剂和免疫药物联合治疗r/mCC的研究相继开展。其中,齐鲁制药研发的抗PD-1和抗CTLA-4双功能检查点抑制剂——艾帕洛利托沃瑞利单抗(Iparomlimab/Tuvonralimab,QL1706)相关的临床试验备受瞩目。近期,其在r/mCC一线治疗领域取得了阶段性进展,有望开创宫颈癌双免疫治疗的新格局,相关结果将在ESMO 2023大会进行简短口头报告,相信会为双免疫及宫颈癌治疗领域提供新的证据。 强强联合,PD-1和CTLA-4双通路协同 肿瘤细胞能够使部分免疫检查点失活,造成抗肿瘤免疫反应失调,促进肿瘤生长和增殖1。以PD-1和CTLA-4为代表的免疫检查点分子,在调节T细胞抗肿瘤功能方面发挥着核心作用2。 CTLA-4参与免疫反应的负调节3-4,CTLA-4抑制剂通过解除CTLA-4对T细胞的抑制作用,提高T淋巴细胞对肿瘤靶向肿瘤相关抗原(TAAs)的应答水平,增强免疫细胞的抗肿瘤效应2。PD-1通过与其配体结合,抑制T细胞增殖和细胞因子产生,降低效应T淋巴细胞活性,诱导T淋巴细胞凋亡,负向调控抗肿瘤免疫反应,在宫颈癌等多种肿瘤细胞中高表达5。PD-1/PD-L1抑制剂选择性阻断上述过程,恢复抗肿瘤免疫力,同时增强细胞毒性T细胞参与的溶瘤作用2。 PD-1/PD-L1抑制剂或CTLA-4抑制剂单药治疗反应率均较低4,而二者联合治疗的治疗反应率有所升高,其机制主要为6-9:(1)增加CD4+/CD8+T细胞对肿瘤组织的浸润,从而提高CD4+/CD8+T细胞与Treg细胞的比例,发挥抗肿瘤作用;(2)CTLA-4与PD-1/PD-L1抑制剂同时应用能够发挥抗肿瘤协同作用,进一步促进T细胞活化,且二者细胞内信号传导均与PI3K/AKT/mTOR信号通路相关,因此可同时阻断双免疫检查点。这种“强强联合”的治疗模式使临床医生对于免疫治疗的认识更进一步,也对双免疫疗法更加期待。 艾帕洛利托沃瑞利单抗作为全球首个抗PD-1和抗CTLA-4的双功能组合抗体,同时抑制PD-1和CTLA-4介导信号通路发挥协同抗肿瘤作用。该药由新型组合抗体技术平台Mabpair®生产,通过电荷改造等手段,防止抗体的重链和轻链出现错配,从而在保持高表达、易纯化、高活性、高稳定性特点的基础上,使单个细胞以约2:1的比例稳定生产工程化单克隆抗体(图2)10-11。在安全性方面,由于CTLA-4 IgG1抗体在体内有更短的清除半衰期,降低CTLA-4抗体在体内的暴露时间,继而减轻双免疫治疗的不良反应,免疫相关不良事件(irAE)相应降低10。
图2.艾帕洛利托沃瑞利单抗作用模式图 艾帕洛利托沃瑞利单抗闪耀ESMO 2023
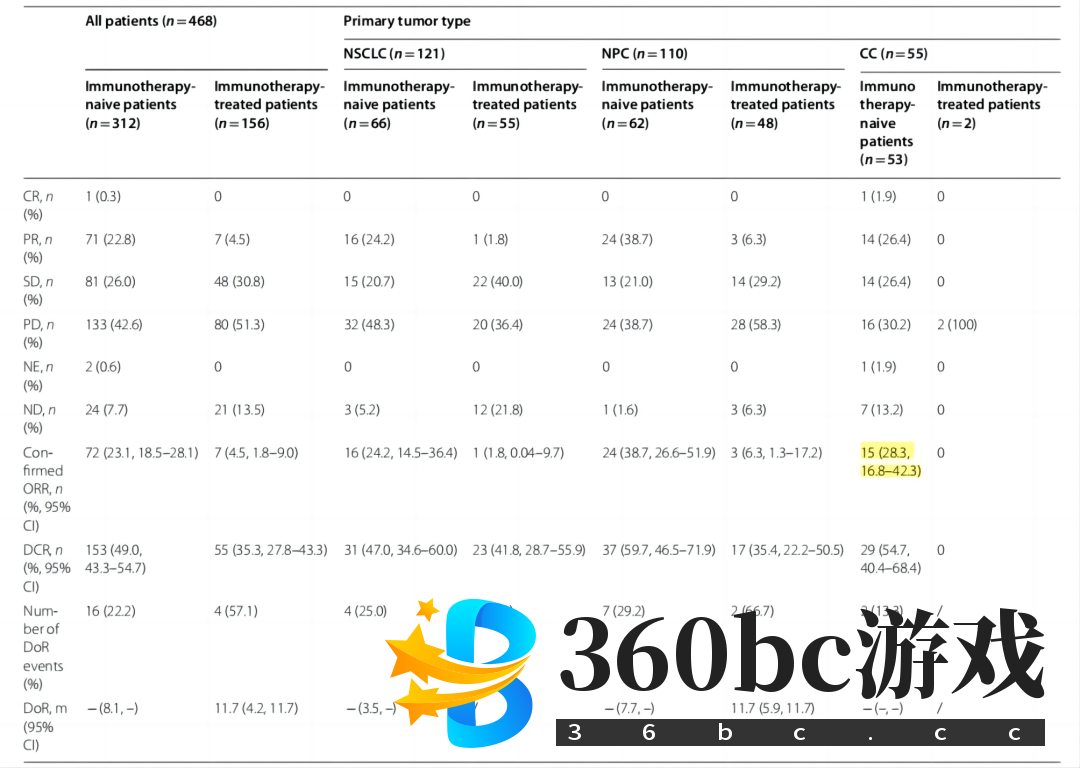
图3. ESMO 2023 口头报告743MO ESMO 2023中,一项单臂、多中心的艾帕洛利托沃瑞利单抗联合化疗加或不加贝伐珠单抗治疗r/mCC的Il期临床试验(CT.gov NCT05179317)成功入选口头报告(摘要号:743MO,图3)12,届时将由主要研究者辽宁省肿瘤医院王丹波教授现场汇报最新结果。 该项研究的背景是基于免疫联合化疗一线治疗PD-L1阳性r/mCC已成为国际广泛接受的治疗策略。更重要的是,艾帕洛利托沃瑞利单抗此前已在Ⅰ期临床研究中显示出在晚期实体瘤患者中耐受性良好,尤其在未接受过免疫治疗的晚期宫颈癌患者中确认的客观缓解率(ORR)达到28.3%(图4)10。
图4.艾帕洛利托沃瑞利单抗Ⅰ期临床研究中总体治疗反应 该研究纳入未接受过系统治疗的r/mCC患者,分别接受艾帕洛利托沃瑞利单抗(5 mg/kg,IV,D1)联合化疗(队列1)或再联合贝伐珠单抗治疗(15 mg/kg,D1/D2)(队列2),每3周治疗一次,共6个周期。此后,艾帕洛利托沃瑞利单抗加或不加贝伐珠单抗维持治疗,直至疾病进展、出现不可耐受的毒性或其他停药事件。研究的主要终点为安全性,次要终点包括研究者评估的疗效等。让我们共同期待在ESMO 2023大会上,研究者现场公布的关于药物疗效和安全性的详细数据。 艾帕洛利托沃瑞利单抗作为一款重磅的原研国产创新抗肿瘤药物,已在宫颈癌、非小细胞肺癌等多个瘤种中开展研究,此前取得的重要治疗进展已在众多国内外重磅学术会议上公布,包括美国癌症研究学会(AACR)年会、美国临床肿瘤学会(ASCO)年会、中国临床肿瘤学会(CSCO)年会等。希望未来随着更多研究结果的公布,艾帕洛利托沃瑞利单抗能够为我国宫颈癌患者带来更多切实的获益,改善现存的药物种类少、适应证范围窄、缺乏最佳剂量和治疗策略等临床问题。 更多艾帕洛利托沃瑞利单抗的研究详情、ESMO现场精彩报道及深度专家访谈将陆续推送,敬请期待! 参考文献: 1.李涛,张侃,杨文雨等.免疫检查点抑制剂CTLA-4在实体肿瘤治疗中的临床应用[J].协和医学杂志,2023,14(03):652-659. 2.Ephraim R, Fraser S, Nurgali K, et al. Checkpoint Markersand Tumor Microenvironment: What Do We Know?[J]. Cancers (Basel), 2022, 14: 3788. 3.Rowshanravan B, Halliday N, Sansom DM. CTLA-4: A moving target in immunotherapy[J]. Blood, 2018, 131(1): 58-67. 4.冯淑娴,田珲,肖红妮.PD-1/CTLA-4双靶点抗体在复发或转移性子宫颈癌中的研究进展[J].中国妇产科临床杂志,2023,24(04):419-421. 5.Krummel MF,Allison JP. CTLA_4 engagement inhibits IL-2 accumulation and cell progression upon activation of resting cells. J Exp Med, 1996,183:2533-2540. 6.Felix J, Lambert J, Roelens M, et al. Ipilimumab reshapes T cell memory subsets in melanoma patients with clinical response[J]. Oncoimmunology, 2016, 5: 1136045. 7.Gubin MM, Esaulova E, Ward JP, et al. High-Dimensional Analysis Delineates Myeloid and Lymphoid Compartment Remodeling during Successful Immune-Checkpoint Cancer Therapy[J]. Cell, 2018, 175: 1014-1030. 8.Rotte A. Combination of CTLA-4 and PD-1 blockers for treatment of cancer[J]. J Exp Clin Cancer Res, 2019,38:255. 9.Willsmore ZN, Coumbe B, Crescioli S, et al. Combined anti-PD-1 and anti-CTLA-4 checkpoint blockade: Treatment of melanoma and immune mechanisms of action[J]. Eur J Immunol, 2021,51: 544-556. 10.Zhao, Y., Ma, Y., Zang, A. et al. First-in-human phase I/Ib study of QL1706 (PSB205), a bifunctional PD1/CTLA4 dual blocker, in patients with advanced solid tumors. J Hematol Oncol 16, 50 (2023). 11.DUBHE-L-304: A randomized, double blinded, multicenter phase 3 study of platinum-based chemotherapy with or without QL1706 as adjuvant therapy in completely resected stage II-IIIB NSCLC.2023 ASCO,TPS8606. 12.ESMO 2023官网:https://cslide.ctimeetingtech.com/esmo2023/attendee/confcal/session/list?q=ql1706&r=st~9 (责任编辑:蚂蚁团队) |